薬剤師のための治験業界 転職ナビ

治験業界への転職3つのポイント



新しい薬ができるまで



治験の流れ(3つのプロセス)



治験のルール=GCP
治験を実施している医療機関や医師に対してGCPをしっかり守らせることも臨床開発モニター(CRA)や治験コーディネーター(CRC)の大切な役割です。CRAやCRCとして採用されると、GCPについて必ず長い時間を割いた研修が行われます。
GCPの主な内容
- 被験者の人権保護(インフォームド・コンセントの厳格化)
- 治験で得たデータの信頼性の確保
- 治験依頼者(製薬会社)と医療機関の責任・役割分担の明確化
- 記録の保存
もしGCPが守られなかったなら?
- 被験者の同意なく、治験が行われる恐れがある…
- 治験のデータが捏造・改ざんされる恐れがある…
- 安全性や効果が疑わしい新薬が発売されてしまう…
CROとSMO


CROとは?
- Contract Research Organization(医薬品開発業受託機関)。製薬企業は、より科学的かつ倫理的な臨床試験の実施が義務づけられるようになりました。また近年では国際的な医薬品開発競争が激化しており、各製薬会社とも効率的な治験の実施を行うために、自社だけでなく外部機関であるCROに治験を依頼するケースが年々増加しています。
- CROは治験を実施する医療機関を選定し、CROの社員であるCRA(臨床開発モニター)がモニタリング業務を行います。
SMOとは?
- Site Management Organization(治験施設管理機関)。1998年のGCP改定により、治験を実施する医療機関が行う治験関連業務が増大したため、限られた人員・時間内で治験業務を行うのが困難になりました。
- SMOは、医療機関と契約し、GCPに基づいた円滑な治験が実施できるよう、医療機関において治験業務を支援します。質の高い治験を円滑に行うために、CRC(治験コーディネーター)と呼ばれる専門スタッフを育成し、各医療機関にて担当医師への内容説明、被験者の選定などさまざまな業務を行い、治験実施をサポートしています。
医薬品業界の現状とCRO
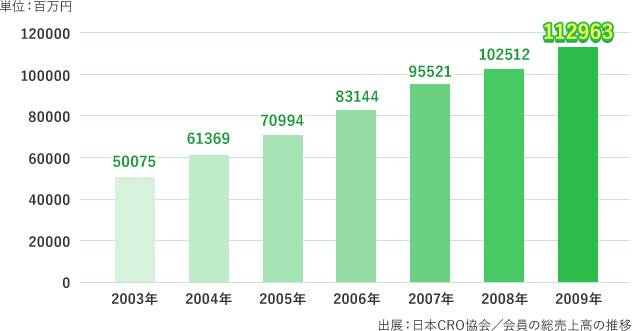
そのため、新薬開発業務のアウトソーシング化は今後ますます進んでいくと考えられています。CROは急速な発展を遂げ、現在は欧米の医薬品開発業務の半数近くをCROが受託しているといわれています。一方、日本では未だ10%前後に過ぎず今後の大きな発展の余地がある注目すべき業界といわれています。実際、2003年以降、右肩上がりに伸びています。

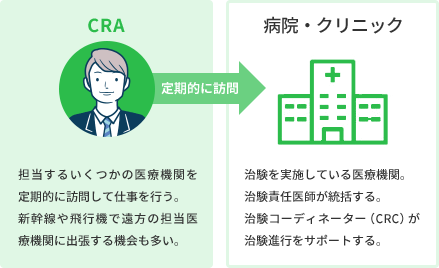
CRA(臨床開発モニター)とは?
CRAとは、Clinical Research Associate:臨床開発モニター担当者の略称です。
治験実施医療機関内で行われる治験が、様々な法律やルールを守って実施されていることを確認する業務(モニタリング)を行うとともに、依頼者である製薬企業と、ドクターをはじめとする医療機関のスタッフを結ぶ橋渡し役となり、ドクターが作成するCRF(症例報告書)を回収します。 ※Associate:[名](仕事・事業などの)提携者、仕事仲間
CRA(臨床開発モニター)の役割
CRAの主な業務
- 治験を実施する医療機関の治験実施スタッフへの説明会開催
- 治験薬の医療機関への引き渡し
- GCPを守って治験が行われているかモニタリング
- 治験ファイルの点検
- 有害事象への対応
- 症例報告書の回収
- 原資料の検証/直接閲覧(SDV)
-
モニタリング訪問報告書(通称:モニホー)の作成
被験者から治験前に文書で同意を得ているか
治験責任医師がGCP基準等に従っているか
有害事象が発生していないか …等々
CRA(臨床開発モニター)のやりがい(一例)
CRA経験者からよく聞く「やりがい」
- 自分の仕事のひとつひとつが、新薬を待ち望む患者様のためになっていくこと。(患者様 のために貢献していることを実感できる)
- 自分の努力次第で仕事の質や評価、年収をあげることができる可能性が高いこと。
- 様々な立場、職種の方と一緒に仕事をするので、これまで以上に世界が広がること。
- メーカーから仕事ぶりを認められてプロジェクトに指名されたとき。
- 自分が携わった医薬品が無事発売されることになった時の達成感。

CRA経験者が語る「仕事の苦労」
- 仕事の状況によって残業、出張がある。(出張は楽しみというCRAも、もちろんいる)
- 忙しい医師とのコミュニケーション。(医師とうまくコミュニケーションがとれるように なった時は、素直に嬉しいと感じる)
- 製薬会社と医療機関の板挟みと感じるときもある。

CRAのある1日
| 8:45 | 出社 CRCや製薬会社から送られてくる新着メール(有害事象の報告等)を確認・返信。担当施設の訪問準備を行います。施設へ直行する日も少なくありません。 |
|---|---|
| 10:30 | 治験実施施設に出発(新幹線移動) 治験実施施設は近隣の施設ばかりではありません。この日は日帰り出張。東京駅から新幹線に乗車します。会社によっては施設は全国に及びますので、宿泊を伴う出張も月に数回あります。 |
| 13:00 | 担当施設に到着 治験責任医師、CRCと面談。治験の進行状況を確認したり、新たな安全性情報を報告したりします。また、記載済みの症例報告書を回収します。 |
| 17:00 | 業務終了。自宅へ直帰 業務が終了したら新幹線に乗り、帰京します。そのまま宿泊先に向かうこともありますが、この日は日帰り出張。会社へ戻らずそのまま自宅へ直帰します。 |
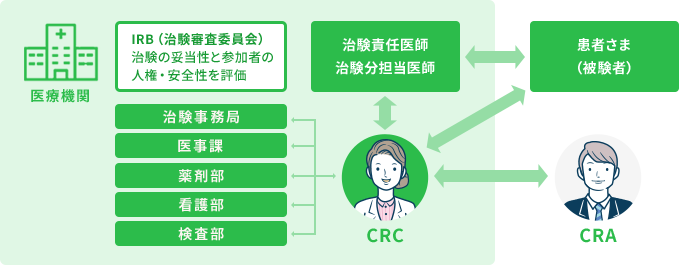
CRC(治験コーディネーター)とは?
治験責任医師の指示のもと、医学的判断を伴わない治験業務の支援を行います。実際に行う職務には、治験準備業務及び治験支援業務があります。新薬の誕生を待ち望んでいる患者様の一番近くで、新薬開発に貢献する職種です。

治験準備業務
- 治験実務計画書の把握
- 治験資材の確認等、治験依頼者との調整
- 院内説明会の開催および関係者との役割分担、確認
- 来院スケジュール表、その他必要資材の準備
治験支援業務
- 同意説明、同意取得の補助業務
- 治験実施計画書に沿った来院日・検査スケジュールの管理
- 検査データの収集および管理
- 被験者のケア
- 症例報告書(CRF)の作成支援
- 有害事象への対応
- 原資料閲覧(SDV)への対応
CRC(治験コーディネーター)のやりがい(一例)
CRC経験者からよく聞く「やりがい」
- 治験に参加した被験者さんから『参加してよかった!』と言われた時。
- ひとりひとりの被験者様とじっくり関われること。
- 院内の通常業務の中に治験をうまく組み込めるようコーディネートし、関係者の皆様の評価を頂いた時。
- 様々な立場、職種の方と一緒に仕事をするので、これまで以上に世界が広がること。
- 治験のことなら、あなたに聞けば安心だねと関係者の方から言ってもらえる時。

CRC経験者が語る「仕事の苦労」
- 施設の中では最初は部外者なのでコミュニケーションは重要。
- 医師等院内スタッフ、患者さま、製薬会社のモニター等多くの方と接するので、調整が大変だが、頼りにされることも多い。
- 書類を多く作成するようになったので最初は戸惑いがあった。

CRCのある1日
| 8:45 | 出勤 新着メールを確認・返信。他のCRCとの情報交換やミーティング等を行う。担当施設へ直行することもあります。 |
|---|---|
| 11:00 | 担当施設まで移動/ランチタイム スケジュールを確認して、本日のアポイント先である担当施設(医療機関)へ出発します。 |
| 13:30 | 担当施設に到着/業務の準備 来院予定の被験者のカルテをチェックします。また被験者の来院時間を医師や薬剤師に報告し、前回来院時の検査結果確認、治験薬の準備などを行います。 |
| 14:00 | 被験者と面談/医師の診察 被験者と面談し、有害事象の有無や服薬状況を確認。被験者への気遣いも大切な仕事です。その後、医師からの依頼により被験者への治験の補足説明を行います。医師の診察後、再び被験者と面談し、服薬方法の指導や次回来院日時を設定します。また治験協力費の支払い手続きも行います。 |
| 15:00 | 診察後の処理・報告など カルテ記載内容を確認し、医師へ業務報告を行います。また、CRAへ被験者の状況を報告します。その後、症例報告書への記載、次回訪問日時を報告します。 |
| 17:00 | 帰社 帰社後、新着メールを確認・返信、必要書類の作成。日報を提出して、この日は業務終了。 |
治験業界への転職に関するよくある質問
皆さまからよくお寄せいただく質問に、マイナビ薬剤師のキャリアアドバイザーがお答えします。
-
薬剤師ですが、企業で働いたことがないので不安です。
薬局・病院以外で働いた経験はあまりない方にとって、名刺の渡し方や、電話のかけ方など、不安に思われることも多いと思います。しかし、多くの治験関連企業では入社時の研修において、名刺の受け渡しや電話対応などの基本的なビジネスマナーを学ぶ講座を用意しています。充実した研修を設けている企業も多いため、現時点であまり気にする必要はないと思いますよ。
-
CRAとCRC、自分にはどちらが向いているのでしょうか?
どんな職業にも向き・不向きがあると思います。どちらが向いているかは、その方の考え方やお仕事に対する考え方によって異なってきますので、私たちキャリアアドバイザーが、お一人おひとりの考え方を伺った上で、アドバイスいたします。お気軽にご相談ください。
-
女性の場合、結婚・出産後も仕事を続けられますか?
治験業界は総じて女性比率の高い業界です。もともと薬剤師自体も女性の方が多いからです。まさに女性のパワーで支えられた業界ですね。そのため他業界に比べると女性が長く続けられる環境を整えた企業が多いのも治験業界の特徴です。例えばCRAの場合、外勤や出張がどうしても伴うのですが、お子さまが小さい間は内勤の職務に配置するなどの措置をとっている企業もあります。
-
CRAやCRCに必要とされる資質とは?
治験や疾病・検査に関する学習意欲があることが大前提ですが、知識面では入社後に勉強する機会がたっぷりありますのでそれほど心配する必要はありません。知識以上に必要とされるものが、コミュニケーションスキルです。「自分の考え・意見が的確に伝えられるか」あるいは「相手の話をしっかりと傾聴できるか」。このような基本的なコミュニケーション能力が問われます。会社の代表として、医師や医療スタッフなど大勢の方と信頼関係を築く必要がありますからね。また新薬開発の一端を担う仕事ですので、「生命に対する倫理観の強さ」も当然必要です。
-
CRAの場合、出張が多いと聞きました。出張の頻度はどの程度ですか?
治験を実施している医療機関は全国各地に散らばっていることが多いため、CRAの仕事には新幹線や飛行機などを使った出張が付き物です。 CRAを目指す方は、逆に出張を楽しむくらいの気持ちが必要かもしれません。出張のついでに全国の美味しいもの巡りを楽しんでいる方も多いようです。出張の頻度は企業によっても異なりますが、宿泊を伴うような遠方への出張は月に数回程度のケースが多いようです。
-
CRAとCRCの給与水準は?
CRAの場合、企業によっても異なりますが、治験業界未経験者の場合の初年度年収は諸手当込みで、400万円~500万円前後です。もちろんその後の活躍(昇給や昇格)によって給与もアップします。CRCの場合、300万円台後半~400万円台前半からスタートする企業が多いようです。
-
語学力(英語力)は必要ですか?
特に英語力は必要とされていません。ただし、外資系の製薬会社の治験や国際共同治験も増えているため、優れた英語力を持つ方は将来的に幅広い仕事を任される可能性があります。
-
治験業界にチャレンジする前に、何か勉強すべきことはありますか?
特に改まった勉強は必要ありませんが、最低限の知識だけは身につけておく必要があります。マイナビ薬剤師が開催している転職相談会やセミナーにまずはお越しください。お電話でもご相談を承っています。
募集中の薬剤師求人情報
薬剤師の求人をエリアで探す
マイナビ薬剤師転職サポートの流れ
-


ご登録
ご登録は1分で完了!担当のキャリアアドバイザーからご連絡を差し上げます。
-


求人のご紹介
ご希望に合った求人をご紹介!求人のポイントなど、詳細もご説明いたします。
-


面接・条件交渉
面接対策をアドバイス!また、給与交渉や面接の日程調整等を代行いたします。
-


転職成功!!
入社日の調整や手続きなど、ご入社までサポートいたします。
※在庫状況により、キャンペーンは予告なく変更・終了する場合がございます。ご了承ください。
※本ウェブサイトからご登録いただき、ご来社またはお電話にてキャリアアドバイザーと面談をさせていただいた方に限ります。
「マイナビ薬剤師」は厚生労働大臣認可の転職支援サービス。完全無料にてご利用いただけます。
厚生労働大臣許可番号 紹介13 - ユ - 080554